盘点 | 2021年2月全球获批的新药
- 2021-03-10 16:05
- 作者:章成 梁家康
- 来源:火石创造
2021年2月,全球批准新药数量有所上升,FDA共完成78项药品首次批准(不包含临时批准),其中有7个药物是新获批的新分子实体。EMA共批准7个新药上市,包含新活性物质3个。国内新批准上市药品均为仿制药,科兴中维、武汉生物制品研究所以及康希诺的三款新型冠状病毒疫苗经国家药监局附条件批准上市,目前国内已有四款新型冠状病毒疫苗批准上市。仿制药一致性评价工作稳步开展,注射剂型品种首次被纳入集采,随着注射剂型一致性评价工作的开展,越来越多的注射剂将被纳入带量采购范围。
美国FDA批准情况
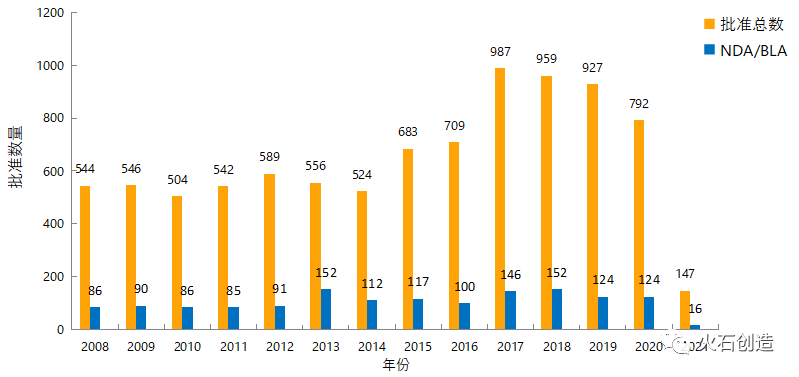
图1 2010—2021年FDA药物批准数量变化情况
数据来源:美国FDA官网
如图1,截至2021年3月2日,FDA官网披露,2021年2月FDA共完成78项药品首次批准(不包含临时批准),其中NDA/BLA批准10个(不包含暂批药物)。其中有7个药物是新获批的新分子实体。
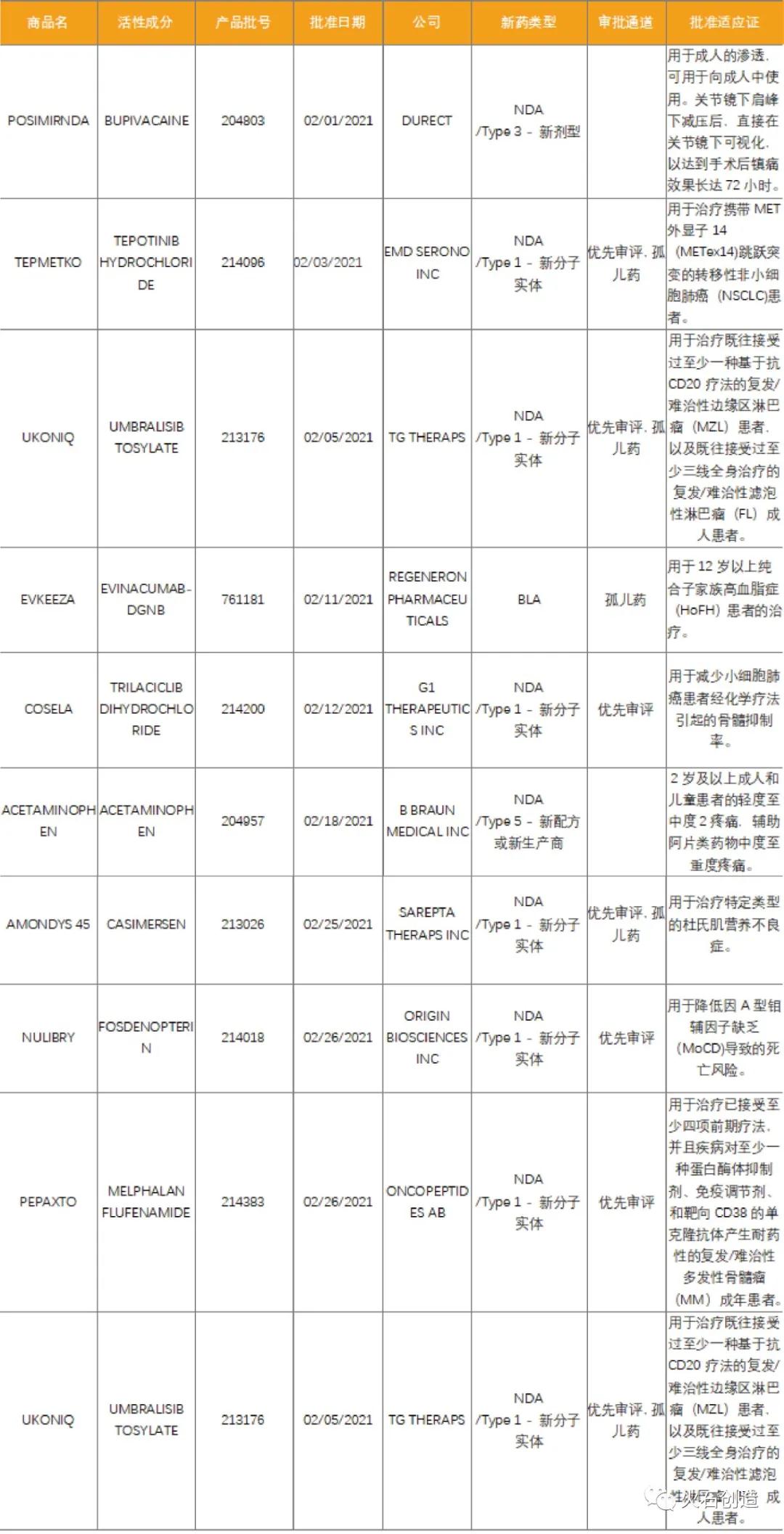
表1 2021年2月FDA批准NDA/BLA药物列表
数据来源:美国FDA官网
欧盟EMA批准情况
截至2021年3月2日,EMA官网披露,2021年2月批准上市药品共计7个,其中新活性物质(New active substance,NAS)3个。2010年至2021年的批准情况见图2。
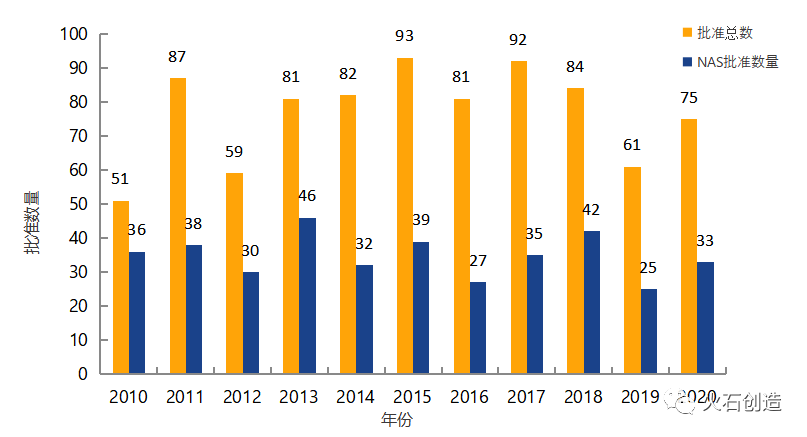
图2 2010—2021年EMA药物批准数量变化情况
数据来源:EMA官网
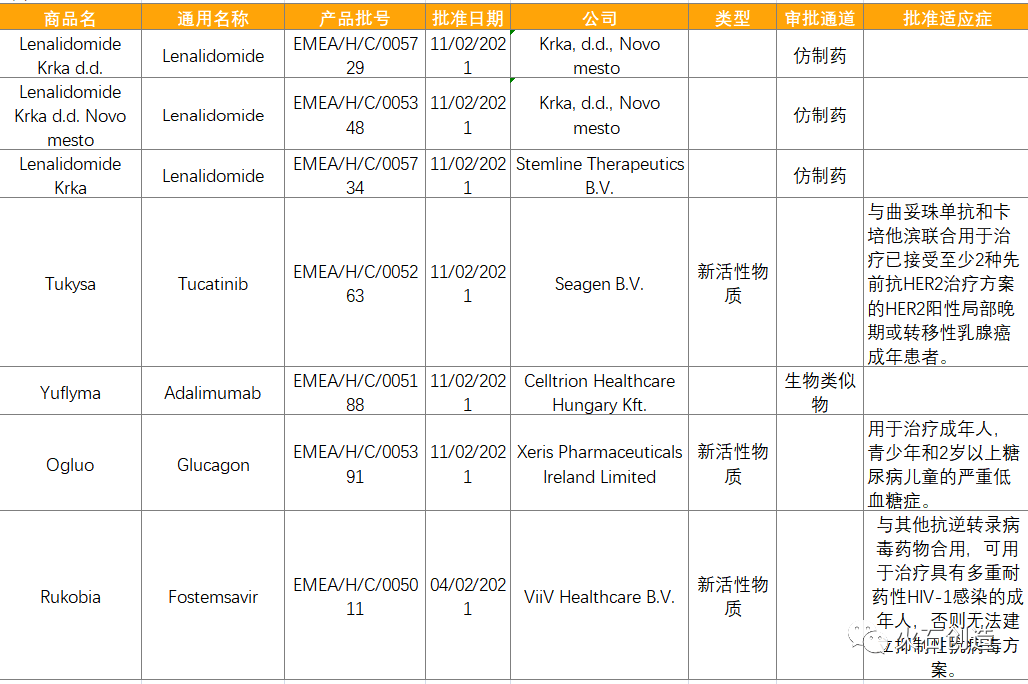
表2 2021年2月EMA批准的药物列表
数据来源:EMA官网
国家药监局批准情况
截至2021年3月2日,国家药监局披露,2021年2月共批准国产首次注册药品35件。按剂型去重后,共27个药品品种。截至目前,国内已有四款新型冠状病毒疫苗经国家药监局附条件批准上市,包括三款灭活疫苗和一款腺病毒载体疫苗。
仿制药一致性评价情况
截至2021年3月2日CDE官网披露,共承办仿制药一致性评价2809个受理号,2月共新增54个受理号获承办。截至2021年3月2日,共2103个品规上市药品通过一致性评价(包含视同通过963个品规),2月共87个品规药品通过一致性评价(包含视同通过49个品规),按剂型去重后,共63个药品品种通过一致性评价,其中包含17个品规的药品为首家过评。
2月过评药品中共计有48个品规(26个品种)的注射剂型,2021年共有130个品规注射剂型通过一致性评价,注射用帕瑞昔布钠、盐酸氨溴索注射液等品种成为注射剂型中申报最多的品种,其中注射用帕瑞昔布钠(40mg)成为注射剂型中通过一致性评价厂家数最多的品规,共有17家企业通过;盐酸氨溴索注射液的通过厂家数也达到14家。2月3日,第四批集采在上海开标,纳入集采的158个品种中,有8个品种的注射剂型,这是注射剂型品种首次被纳入集采,随着注射剂一致性评价政策落地及过评产品增加,越来越多的注射剂将被纳入带量采购范围。2020年至2021年各月份通过一致性评价数量见图3。
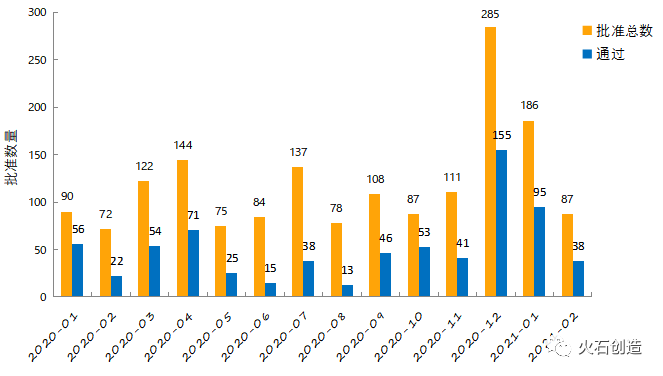
图3 2020年至2021年2月份仿制药一致性评价批准数量变化情况
数据来源:国家药品监督管理局
(本文仅代表作者观点,不代表本站立场)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐